神经精神疾病(Neuropsychiatric disorder)是一个笼统的医学术语,涵盖了涉及神经病学和精神病学的广泛医学病症。世卫组织认定的神经精神疾病包括:单相抑郁症、躁郁症、精神分裂症、癫痫、酒精使用障碍、阿尔茨海默病和其他失智症、帕金森病、多发性硬化症、药物使用障碍、创伤后应激障碍、强迫症、恐慌症、失眠(原发性)、偏头痛、智力低下以及其他神经精神疾病。
2023年,CDER批准的55款NME和新生物制剂中,就包括4款针对神经精神疾病的药物:Leqembi(阿尔茨海默病),Zurzuvae(产后抑郁症),Exxua(重度抑郁症)和Zavzpret(偏头痛)。2024年,这个领域的药物开发仍然是医疗保健市场的重点关注,例如礼来的阿尔茨海默病药物donanemab就很有可能在年初获批。除了donanemab之外,2024年神经精神疾病领域的临床试验和药物开发的热点还包括以下内容:
Risperidone精神分裂症和分裂情感障碍3期研究
Lyndra Therapeutics 2024年初宣布了他们的成人精神分裂症和分裂情感障碍的资产,每周口服一次的risperidone (图1) 的 III 期 STARLYNG-1临床试验积极结果。
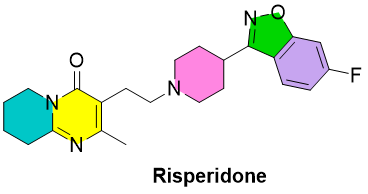
图1. Risperidone化学结构。
Risperidone是第二代抗精神病药物,用于治疗多种情绪和心理健康状况,包括精神分裂症和双相情感障碍。它是使用最广泛的抗精神病药物之一。精神分裂症和各种情绪障碍是由多巴胺能 D2 和血清素能 5-HT2A 过度活跃引起的,分别导致中枢中脑边缘通路和中皮质通路过度活跃。Risperidone可以抑制大脑中的多巴胺能 D2 受体和血清素能 5-HT2A 受体并减少这种过度活动。
Risperidone在1993年已经获得了FDA的批准,STARLYNG-1 的目的是补充完善之前呈递的risperidone治疗精神分裂症和双相情感障碍的安全性和有效性数据,这是FDA允许的。该研究在中期评估阶段达到了主要终点,还达到了安全性以及次要终点,因此提前终止了III期研究。Lyndra 将于 2024 年下半年针对精神分裂症和分裂情感障碍患者启动一项为期六个月的双盲关键安全性研究,还在在针对 I 型双相情感障碍进行研究。
AD101阿尔茨海默病3期研究
AmyriAD Therapeutics的阿尔茨海默病小分子候选药物 AD101 的三项III 期研究即将展开。
这三项III 期研究中,两项(一项美国试验,另一项在欧洲和东南亚地区)为安全性和有效性的充分且良好对照 (AWC) 研究,每项将招募 500 名患者。AD101 的 2 期临床试验数据已经证明了阿尔茨海默病患者认知和整体功能的改善。
AD101 是一种每日一次的低压门控 T 型钙通道调节剂,可增加内源性乙酰胆碱的释放。美国试验定于 2024 年第三季度开始,欧洲和东南亚试验暂定于 2025 年第一季度开始。一旦患者完成 AWC 研究的参与,将进行开放标签 III 期扩展研究,以表征治疗的长期安全性和有效性。
AmyriAD 的CEO Sharon Rogers博士表示,2023年获批上市的阿尔茨海默病疗法Leqembi针对的是非常轻度认知障碍类型的患者。在针对全部患者群体时,AD101 与 Aricept (阿尔茨海默病目前的常规疗法) 等疗法联合使用有望起到更大的作用。Aricept通过抑制分解神经递质乙酰胆碱的酶来保护神经递质乙酰胆碱,而 AD101 则调节钙流入突触前神经元,增强乙酰胆碱的释放(图2)。
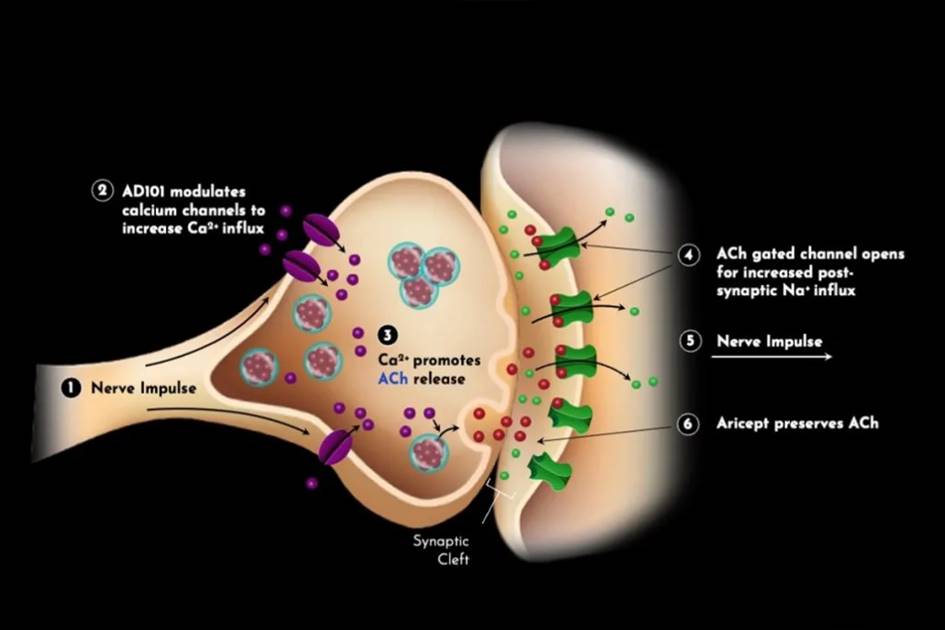
图2. AD101与阿尔茨海默病药物Aricept联合疗法机理示意图。
图片来源:Longevity.technology
强生抑郁症药物Aticaprant
强生针对抑郁症的小分子候选物Aticaprant(图3),可能将于今年6月份公布3期数据。这项3期试验NCT05455684已招募了约 540 名参与者,测试强生公司的资产Aticaprant是否可以作为附加疗法来改善某些患有重度抑郁症的成年人的症状。Aticaprant 最初由 Eli Lilly 开发,曾由 Cerecor 开发过一段时间,现在由 Janssen Pharmaceuticals 开发。
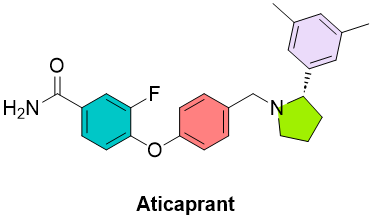
图3. Aticaprant化学结构。
Aticaprant 可抑制 KOR(kappa 阿片受体),KOR是一种参与多种神经系统功能(从压力到疼痛到情绪调节)的G偶联蛋白受体(GPCR)。强生对aticaprant抱有很高的期望,将其视为公司的关键增长动力,预测销售额峰值将达到 10 亿至 50 亿美元。
然而瞄准KOR靶向药物的远不止强生。Neumora Therapeutics 同样拥有自己的 KOR 靶向药物,并处于后期开发阶段。如果87 亿美元收购 Cerevel Therapeutics 的计划能够得偿所愿,艾伯维也将推出一款同类型产品。
精神分裂症疗法的曙光KarXT
对于精神分裂症患者来说,治疗是一个终生的抗精神病药物和心理治疗过程。药物是控制病情发作的关键,但大多数药物都伴有明显的副作用,包括肌肉运动失控、体重增加和嗜睡,这导致了患者依从性很低。
在《柳叶刀》去年12 月 14 日发表的一项研究中报告了一种精神疾病新疗法KarXT(xanomeline-trospium),可以为患者提供更好的选择。KarXT 由Karuna Therapeutics与再鼎医药联合开发,其另辟蹊径的开发途径让人们对其高度关注,它可能将实现神经分裂症疗法的药理学突破。
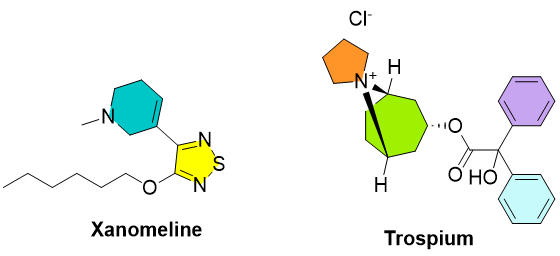
图4. KarXT(xanomeline-trospium)化学结构。
与现有的针对大脑化学物质多巴胺的精神分裂症治疗不同,KarXT 的目标是大脑中参与认知的毒蕈碱神经递质系统(muscarinic neurotransmitter)。脑细胞上的毒蕈碱受体与大脑化学物质乙酰胆碱结合,乙酰胆碱是阿尔茨海默病等治疗的目标。在KarXT对这些患者进行的研究中,科学家发现患有阿尔茨海默病精神病的患者似乎也受益。通过针对完全不同的神经递质系统,临床数据展现了新的益处,并且副作用的问题得到了控制。KarXT 由毒蕈碱激动剂 xanomeline 和毒蕈碱拮抗剂 trospium 组成,优先刺激中枢神经系统中的毒蕈碱受体,同时改善早期研究中发现的副作用。
KarXT目前正在 3 期临床试验中进行评估,作为治疗精神分裂症以及阿尔茨海默病精神病的单一疗法和辅助疗法。KarXT 是同类药物中第一个具有真正新颖且独特的双重机制的潜在药物,不依赖多巴胺能或血清素能途径来治疗严重精神疾病的症状。这种方法有可能提供差异化的治疗,如果获得批准,将对数百万患有严重精神疾病的人的生活产生有益的影响。
干细胞治疗帕金森病
大多数帕金森病临床试验研究针对的是处于疾病晚期的患者。STEM-PD 试验另辟须经,采用不同的方法,重点关注疾病的早期阶段。干细胞来自患者自身的皮肤或血细胞。通过它们取代大脑中因疾病而丢失的神经元。2023 年 2 月,研究人员开始对 50 至 75 岁的中度帕金森病患者进行研究。这项开创性的研究将于 2024 年底获得初步结果。
首款致幻剂药物可能登上历史舞台
长期以来,致迷幻剂一直都是一块药物开发的禁忌之地,但这个现象可能会在2024年得到改变。
MAPS 公益公司(MAPS Public Benefit Corporation)已于2023年12月向 FDA 提交了一份MDMA(midomafetamine,亚甲二氧甲基苯丙胺)的 NDA(新药申请)。如果FDA批准的话,MAPS将是第一个获得批准的治疗创伤后应激障碍 (PTSD) 的致幻剂类型药物。MAPS 正在寻求批准 MDMA用于心理干预,包括由合格的医疗保健提供者为 PTSD 提供的心理治疗和额外支持服务。
图5. Midomafetamine化学结构。
抛开医学用途来看,MDMA是一种臭名昭著的物质,所谓的“摇头丸”就是由这种化合物制备的。作为N-取代的安非他明类似物,MDMA 是一种被广泛滥用的物质,被归类为致幻剂,会导致大脑血清素系统发生显著持久的变化。它的服用会通过血清素、去甲肾上腺素、多巴胺和催产素的释放产生欣快感。但在创伤后应激障碍治疗领域,MDMA似乎找到了“周处除三害”的感觉。MDMA已被 FDA 授予突破性疗法认定,正在寻求优先审查。
创伤后应激障碍 (PTSD) 每年影响大约 1300 万美国人,目前的治疗方法只能提供有限的疗效,因此迫切需要针对该病症的有效疗法。创伤后应激障碍是由经历或目睹恐怖事件引发的。症状可能包括闪回、噩梦、严重焦虑以及对创伤诱发事件的侵入性想法。
MDMA的NDA 申请得到了 MAPP1 和 MAPP2 的研究结果的支持,这两项研究都是 III 期研究,分析了 MDMA 辅助治疗与安慰剂加心理治疗相比,对中度或中度至重度 PTSD 患者的疗效和安全性。试验发现,MDMA 辅助治疗非常有效, 对于患有严重创伤后应激障碍的患者来说是安全且耐受性良好的。MDMA 辅助疗法代表了一种潜在的突破性疗法。
从目前来看,医疗保健行业已经开始了准备。2023年5月,美国医学会批准了迷幻药治疗的现行程序术语 (CPT) III 代码。CPT 代码用于电子健康记录中,以跟踪医疗服务和报销程序,CPT III 代码则跟踪那些尚未获得 FDA 批准的新兴治疗方法。CPTIII代码的分配,也折射出美国医疗保健领域对这款药物上市的看好。
致幻药的“弃暗投明、改土归流”,将成为FDA历史上一件划时代的事件,可能为更多致幻剂(诸如Psilocybin)“铸剑为犁”向药物的转变铺平道路。
Ref.
Lyndra Therapeutics reports positive Phase III schizophrenia trial study data. Clinical Trials Arena. 05. 01. 2024.
Sullivan, D. AmyriAD’s Alzheimer’s drug ready for Phase 3 trials. 18. 01. 2023.
Fidler, B. et al. 10 clinical trials to watch in the first half of 2024. BipharmaDive. 02. 01. 2024.
Park, A. A New Drug Compound Shows Promise for Schizophrenia. Time. 15. 12. 2023.
KarXT. Karuna Therapeutics. Retrieved on 07. 01. 2024.
A spinal cord neuroprosthesis for locomotor deficits due to Parkinson’s disease. Nature Medicine. Volume 29. November 2023. 2854–2865.
Anderson, M. First FDA-approved psychedelic drug could come as soon as 2024. Healthcare Brew. 27. 10. 2023.
Rodriguez, A. et al. Weight loss, drug prices, abortion and prescribed psychedelics: Expect reckonings in 2024. USA Today. Retrieved on 07. 01. 2024.













